L’épigénétique : une discipline née avec le siècle
Une première approche
« L'épigénétique est l'étude des changements constatés d'activité des gènes — donc des changements de caractères — qui sont transmis au fil des divisions cellulaires ou des générations sans faire appel à des mutations de l'ADN. »
C’est lors du séquençage complet de plusieurs génomes - que l’on se trouvait dans l'incapacité de déchiffrer concrètement, et d'y trouver la totalité des effets phénotypiques observés - qu’on a mis en évidence une certaine variabilité de l’expression du génome en fonction des variations du milieu.
Ainsi un œuf de tortue, bien que disposant d’un génome bien défini, va être capable en fonction de la température de s’exprimer sous forme d’un individu mâle ou femelle. Pourquoi a-t-on des différences de devenir chez les abeilles issues de la même parthénogenèse ? Comment certains reptiles (Dragon de Komodo) sont susceptibles de reproduction monoparentale qui, à partir d’une femelle seule, ne va donner qu’une progéniture mâle !? Etc.
Ces difficultés - inattendues dans le cadre des ségrégations de caractères prévues par Landel et Morgan - évoquent l'idée d'une intervention externe au génome dans la réalisation de son expression phénotypique.
L'épigénétique revendique alors un rôle clef, et se veut un prolongement et un complément de la génétique classique, notamment dans le domaine de la nutrition, ou de la reproduction.
La simplicité de ce ver s'est imposée dans l'étude du vieillissement et de l'apoptose.
Une grande partie des cellules du ver (302) sont des cellules neuronales, permettant également l'étude du système nerveux. Soit 30% ! Ce qui est considérable !
En 1998 ce ver fut le premier dont le génome ait été totalement séquencé : 97 millions de paires de bases réparties en six chromosomes (organisme diploïde) codant 19.099 gènes.
Quarante pour cent d'entre eux auraient des équivalents dans le patrimoine génétique humain, ce qui confirme l’existence fondamentale de gènes de type organisateur dont le rôle dépasse les frontières des espèces.
Par exemple, une même larve d'abeille deviendra une reine ou une ouvrière en fonction de la façon dont elle est nourrie, et un même œuf de tortue peut éclore en mâle ou femelle en fonction de la température. Il s'agit bien de l’expression du même code génétique global, mais des facteurs environnementaux ont sélectionné une expression plutôt qu'une autre, chacune étant disponible dans la « base de donnée » génétique.
Autrement dit, l'épigénétique gouverne la façon dont le génotype est utilisé pour créer un phénotype.
L'épigénétique a donc des applications dans un large champ de disciplines biologiques, de la biologie du développement à l'agronomie et la nutrition en passant par la médecine, et notamment la recherche sur le cancer avec des perspectives thérapeutique nouvelles, notamment avec la création d' « épi-médicaments ».
En matière d'évolution, l'épigénétique permet d'expliquer comment des traits peuvent être acquis, éventuellement transmis d'une génération à l'autre ou encore perdus après avoir été hérités.
Il est curieux de constater que cette conception « post génétique » nous ramène à la conception initiale de Darwin combattue par tous les évolutionnistes qui se sont pourtant appuyés sur ses travaux : il défend l'idée que l'ensemble de l'organisme participe à l'hérédité, c'est ce qu'il nomme pangenèse en 1868.
Dans son ouvrage « La Filiation de l'Homme et la filiation liée au sexe », publié en 1871, Darwin distinguera deux facteurs importants dans l’hérédité :
- la transmission,
- l’actualisation, des caractères hérités.
Son idée était que certains des caractères transmis pouvaient ne pas être apparents chez les géniteurs au moment de la fécondation et qu'ils se manifesteraient au même moment du développement de la progéniture que chez les parents.
Pour être en accord avec sa théorie de la sélection sexuelle, il stipulait également que certains caractères transmis s'actualisaient différemment selon le sexe.
C’est exactement ce qu’illustre aujourd’hui l’épigénétique !
Les
travaux de Sydney Brenner, John Sulston et Robert Horvitz (prix
Nobel en 2002)
Ces biologistes travaillent sur un petit nématode libre (non parasite).
Caenorhabditis elegans
C’est un petit ver transparent d'environ un millimètre de longueur, menant une vie autonome dans le sol.
Son embryogenèse ne dure que 16 heures et peut être facilement observée in vitro.
La plupart des individus sont hermaphrodites (XX) et produisent à la fois des ovocytes et des spermatozoïdes. Il y a quelques mâles (XO).
Ce nématode se reproduit environ tous les trois jours, et sa durée de vie est d'environ trois semaines. Comme les autres nématodes et les Tardigrades, il se développe suivant le processus d’euthélie : à l’âge adulte, il s’accroît par gonflement des cellules en nombre fixe et non plus par multiplication cellulaire !
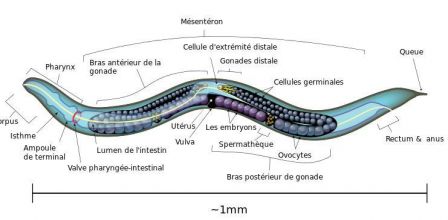
Anatomie
Sexuation
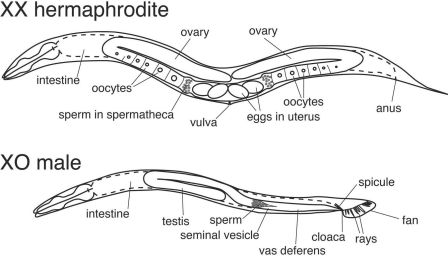
- L'adulte hermaphrodite (99,5 % des individus) est composé de 959 noyaux somatiques.
- L'adulte mâle (0,5 % des individus) est formé de 1031 noyaux somatiques
- Le jeune est constitué de 1 090 noyaux somatiques.
On compte les noyaux et non pas les cellules car cet animal présente des structures syncytiales (un syncytium est un tissus composé d’une série de cellules confondues entre elles par disparition des membranes cellulaires). Le nombre de noyaux témoigne donc du nombre de cellules associé.
Le lignage des cellules est remarquablement invariant d'un individu à l'autre. Il a pu être établi pour toutes les cellules de l’œuf fécondé jusqu'au ver adulte. Au cours de la vie du ver, il y a multiplication au cours de sa croissance, puis mort par apoptose de 131 cellules (représentant la différence entre les 1 090 cellules du jeune et les 959 de l'adulte). Ces cellules se « suicident » à peu près au même moment et au même endroit dans tous les embryons !
C’est l’étude des mécanismes de l’apoptose qui conduisit ces 3 chercheurs au prix Nobel.
La prolifération de cet animal est importante et rapide. A 20 °C, il ne faut que 3 jours à un œuf, pondu par un adulte, pour donner à son tour un adulte capable de pondre des œufs. La croissance d’un individu se fait au travers de mues successives qui rythment les 4 stades larvaires. Chaque adulte peut pondre environ 300 œufs en seulement 5 jours. Par conséquent, un nématode peut engendrer en 10 jours une population de 90 000 animaux génétiquement identiques. Dans les conditions standards de laboratoire, les vers de génotype sauvage peuvent vivre jusqu’à 20 jour, mais il existe des mutations poussant cette limite à plus de 100 jours. Le plus remarquable est que les gènes dont les mutations accroissent la durée de vie du ver sont conservés chez les mammifères (Kenyon, 2010). En outre, si les œufs ne résistent pas au gel, les adultes sont congelables et se réveillent en quelques minutes (comme les Tardigrades) et sont capables de (re)pondre, dès le lendemain.
La simplicité de ce ver s'est imposée dans l'étude du vieillissement et de l'apoptose. Une grande partie des cellules du ver (302) sont des cellules neuronales, permettant également l'étude du système nerveux. Soit 30% ! Ce qui est considérable !
En 1998 ce ver fut le premier dont le génome ait été totalement séquencé : 97 millions de paires de bases réparties en six chromosomes (organisme diploïde) codant 19.099 gènes. Quarante pour cent d'entre eux auraient des équivalents dans le patrimoine génétique humain, ce qui confirme l’existence fondamentale de gènes de type organisateur dont le rôle dépasse les frontières des espèces.
Nous n’avons pas ici le loisir de développer le mécanisme de l’apoptose.(http://www.uvp5.univ-paris5.fr/wikinu/docvideos/Grenoble_1011/berger_francois/berger_francois_p01/berger_francois_p01.pdf)
Nous nous bornerons à dire qu’il s’agit d’un mode actif physico-chimique de destruction de la cellule par fragmentation, par opposition au mode passif qui serait la nécrose.
L’apoptose, mort sélective et programmée est à l’origine de la découpe de certains tissus embryonnaires, (voir syndactylie) et son dérèglement pourrait expliquer la prolifération dans élimination des cellules cancéreuses.
L’intérêt proprement épigénétique de l’animal est liée à la mise en évidence de la transmission de l'attirance pour une odeur acquise par l'expérience, transmise sur 3 générations, et reproduite jusqu'à 40 générations si cette caractéristique acquise est renforcée, d’autant que []l'épigénétique est associée à des modifications de longévité, transmises d'une génération à l'autre[].
L’épigénétique n’en est qu’à ses balbutiements, elle a fait des débuts plus que prometteurs et permet une synthèse entre des modèles physico-chimiques trop rigides auxquelles échappent certaines des manifestations de l’expression observée des gènes qui est influencée par le milieu et sans doute aussi les contraintes neurosensorielles.
Dans un article récent, François Gonon et Marie-pierre Moisan, « L’épigénétique, la nouvelle biologie de l’histoire individuelle ? » p. 21 -Revue française des affaires sociales 2013 – écrivent :
« Trois voies de transmission [des caractères] sont possibles : la transmission héréditaire par les cellules germinales, ovocyte et spermatozoïdes, l'imprégnation in utero et la transmission par les interactions sociales. »
On comprend ainsi – ce qui était intuitivement envisageable – que les mères porteuses ont par nature un impact direct certains sur l’acquisition de caractères par le fœtus - de source embryologiquement étrangère - qu’elles portent.
En 2010, Frances Champagne met en corrélation la malnutrition, le stress et l'exposition aux produits toxiques de la mère avec l'état de santé des enfants voire des petits enfants. Des études ont montré que les enfants de femmes enceintes durant les événements du 11 septembre 2001 possédaient un taux de cortisol plus élevé.
Ce contexte a déjà ouvert la voie à la manipulation et à l’exploitation idéologique :on peut déjà ainsi lire dans la même veine que « la mémoire traumatique de l’Holocauste se transmettrait génétiquement ». Il est précisé alors :« Il s’agit de la première démonstration de transmission d’un traumatisme parental à son enfant, associé à des changements épigénétiques[]».
Il fallait y penser !
Ces phénomènes impliqueraient que certaines maladies ne sont pas dues à mutations, c’est à dire à variations de la séquence d’ADN mais peut-être à des « épimutations ». Par exemple, une anomalie épigénétique serait impliquée dans plus de la moitié des cas de syndrome de Silver-Russel .
Mécanisme
biochimique
L'ADN s'enroule en bobine autour des histones, protéines avec lesquelles il forme une structure à laquelle on a donné le nom de chromatine (quand on l'a observée au microscope grâce à une coloration chromatique).
On a déjà mis en évidence l’altération de l’ADN par le méthyle, ce que l’on appelle la méthylation ; plus précisément la méthylation de cytosine en 5-méthylcytosine des paires de base Cytosine-Guanine ; ce qui conduit à inhiber l'expression génétique d'un brin d'ADN :
- une faible méthylation se traduit le plus souvent par une forte expression du gène,
- alors qu'un haut niveau de méthylation inactive le gène.
Cependant, ce n’est pas général : il existe des exemples où une forte méthylation n'a pas de répercussions sur le niveau d'expression.
La méthylation de l'ADN est cependant l'acteur majeur de la mise en place de l'empreinte parentale, mécanisme par lequel l'expression d'un gène va dépendre de l'origine parentale. Par exemple, dans le cas d'un gène à expression maternelle, l'allèle paternel est méthylé et entièrement éteint alors que l'allèle maternel est non méthylé et entièrement exprimé.
Or il existe une interdépendance entre la méthylation de l'ADN et celle des histones : on a montré une interaction entre certaines protéines à activité de méthylation de l'ADN et un système de méthylation des histones. Nous sommes donc en présence d'un lien direct entre les activités enzymatiques responsables de deux mécanismes épigénétiques distincts.
L'épigénétique est donc un système régulateur fondamental au-delà de l'information contenue dans la séquence d'ADN.
Le gène défini par Mendel doit maintenant être considéré avec la chromatine qui l'entoure puisqu'elle joue un rôle primordial dans la régulation transcriptionnelle et que, de plus, elle est héréditaire tout comme les gènes mendéliens.
Nous n’en dirons pas plus ici : les données dont on dispose sont à l’évidence fragmentaires et peu nombreuses, c’est la conséquence de l’extrême jeunesse de cette discipline qui explique pourquoi les résultats de la transmission des caractères dits acquis échappent parfois aux modélisations prévues par la génétique.
Claude Timmerman